- Elektromagnetische Felder
- Gefahrenschwerpunkt Frachtcontainer
- Innenraumarbeitsplätze
- Kühlschmierstoffe
- Praxishilfen: Ergonomie
- Praxishilfen: Gefahrstoffe
- Praxishilfen: Lärm
- Praxishilfen: Maschinenschutz
- Praxishilfen: Persönliche Schutzausrüstungen
- Praxishilfen: Vibration
- Produktsicherheit
- Tätigkeiten mit krebserzeugenden Gefahrstoffen
- Nanomaterialien
Alkane/Paraffine
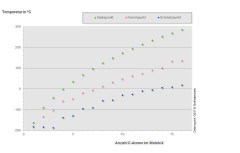
Bild 2: Schmelz-, Siede- und Flammpunkte verschiedener n-Alkane in Abhängigkeit von der Kohlenstoffzahl
Bild: IFA
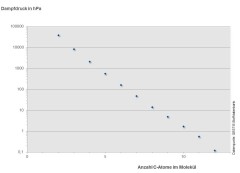
Bild 3: Dampfdrücke verschiedener n-Alkane in Abhängigkeit von der Kohlenstoffzahl
Bild: IFA
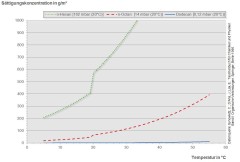
Bild 4: Sättigungskonzentrationen verschiedener n-Alkane in Abhängigkeit von der Temperatur
Bild: IFA
Alkane, früher auch Paraffine genannt, sind gesättigte Kohlenwasserstoffe. Sie enthalten lediglich Kohlenstoff-Kohlenstoff-Einfachbindungen in ihrem Gerüst (s. Bild 1). Das Kohlenstoffgerüst der Alkane kann sowohl eine unverzweigte Kette (n-Alkane, n-Paraffine) aufweisen, als auch in verzweigter Form (iso-Alkane, Isoparaffine) vorliegen. Die allgemeine Summenformel der Alkane lautet CnH2n+2.
Alkane sind überwiegend farblose Substanzen. Die flüssigen Verbindungen riechen benzin- bzw. petroleumartig und sind aufgrund ihres unpolaren Charakters mit stark polaren Lösemitteln (bspw. Wasser) nicht mischbar. Ihre Dichten liegen im Bereich von 0,6 bis 0,8 g/ml.
Mit zunehmender Kettenlänge (Kohlenstoffzahl) steigen die Siede- und Flammpunkte der n-Alkane stetig an. Ab einer Kettenlänge von drei Kohlenstoffatomen (Propan) nehmen auch die Schmelzpunkte mit zunehmender Kohlenstoffzahl kontinuierlich zu (s. Bild 2). In der Gruppe der i-Alkane (verzweigte, gesättigte Kohlenwasserstoffe) besteht kein eindeutiger Zusammenhang zwischen der Anzahl der Kohlenstoffatome und den Siede- bzw. Schmelzpunkten. Allgemein lässt sich aber feststellen, dass die Siedepunkte immer und die Schmelzpunkte oft tiefer liegen als bei den entsprechenden n-Alkanen. Außerdem nimmt der Siedepunkt bei gleicher Anzahl an Kohlenstoffatomen mit zunehmender Verzweigung ab.
Die Dampfdrücke der Alkane sinken mit steigender Kettenlänge. Während die niedrigsiedenden Kohlenwasserstoffe leicht verdampfen, gehen die höhersiedenden Alkane (mehr als 15 Kohlenstoffatome) bei Raumtemperatur kaum dampfförmig in die Luft über. Dies zeigt sich auch, wenn der Dampfdruck gegen die Anzahl der Kohlenstoffatome im Molekül aufgetragen wird (s. Bild 3). Dementsprechend nimmt auch die Sättigungskonzentration der Alkane in Luft mit steigender Kettenlänge ab. Je kürzer das Kohlenstoffgerüst ist, desto größer ist auch die Sättigungskonzentration. Die Werte hängen dabei stark von der Temperatur ab (s. Bild 4). Aufgrund des exponentiellen Verlaufs, steigen die Sättigungskonzentrationen zunächst langsam, dann aber steil mit der Temperatur an. So beträgt die Sättigungskonzentration für Hexadecan (C16H34), einen bei Raumtemperatur festen Stoff, bei 30 °C schon 15 mg/m3. Für Octan (C8H18) liegt die Sättigungskonzentration bereits bei Raumtemperatur im Gramm-pro-Kubikmeter-Bereich.
Alkane sind aufgrund ihres gesättigten Charakters (keine Doppelbindungen) und durch das Fehlen von funktionellen Gruppen reaktionsträge. Chemische Reaktionen können nur unter Bruch der Kohlenstoff-Wasserstoff- bzw. der Kohlenstoff-Kohlenstoff-Einfachbindungen ablaufen. Durch das Fehlen von funktionellen Gruppen laufen chemische Reaktionen in der Regel unselektiv ab.